Различные методы молекулярно-генетической диагностики в онкологии предоставляют врачу (химиотерапевту, клиническому онкологу) сведения о наличии, расположении и типе мутаций в генах конкретного пациента. Информация о мутациях (и их сочетаниях) помогает выбрать наиболее эффективный вариант лечения уже диагностированного онкозаболевания, либо указать на чрезвычайно высокую вероятность рака, передающегося по наследству (так называемые наследственные или семейные раки).

Секвенатор Illuminaдля выполнения секвенирования генома нового поколения (NGS), установленный в молекулярно-генетической лаборатории МИБС
Основные практические задачи, которые решает молекулярно-генетическое тестирование в онкологии
- поиск “поломок” в генах клеток опухоли с целью выявления наиболее эффективной тактики лечения - например, для определения мутаций, при которых эффективной будет иммунотерапия или таргетная терапия;
- раннее профилактическое выявление генных мутаций, ответственных за развитие наследственных раков у здоровых пациентов, в чьей семейной истории есть случаи онкологических заболеваний из списка наиболее часто передающихся по наследству - наследственный ДНК-онкотест (на базе NGS).
Список генов, подлежащих рассмотрению, задается задачами исследования. Это позволяет оптимизировать стоимость и срок выполнения молекулярно-генетической диагностики, выбрав оптимальный метод либо комбинацию методов исследования генов ДНК конкретного человека. В онкологии изучению подлежат гены, мутации в которых участвуют в развитии рака.
Наиболее часто с развитием опухолей связаны мутации в таких генах как: BRAF, BRCA, EGFR, HRAS, KRAS, MET и др.
Научно доказано, что клиническую важность имеют не только мутации в отдельных генах, но и сочетание различных мутаций в разных участках генов. По этой причине наиболее эффективно применение методов, которые позволяют выявить мутации в любом из генов, ассоциированных с развитием онкологического заболевания, без предварительного указания зоны поиска (изучается так называемая “панель генов”).
Преимущество в точности интерпретаций получают лаборатории, проводящие поиск сочетаний выявленных мутаций в специализированных постоянно пополняемых базах данных международного уровня.
Секвенирование нового поколения (NGS)
Наиболее информативным методом молекулярно-генетической диагностики в клинической онкологии является секвенирование нового поколения (NGS). Эта методика предусматривает секвенирование (разделение) молекулы ДНК конкретного человека на отдельные гены с последующим рассмотрением и фиксацией найденных отклонений от нормального строения каждого гена из интересующего списка (панели генов).
Панель генов, поиск мутаций в которых методом NGS можно заказать в молекулярно-генетической лаборатории МИБС: ATM, ATR, BARD1, BRCA1, BRCA2, BRIP1, CDH1, CDK12, CHEK1, CHEK2, EPCAM, FANCL, MLH1, MSH2, NBN, NF1, PALB2, PMS2, RAD51B, RAD51C, RAD51D, RAD54L, STK11, TP53, POLE
Основным отличием секвенирования нового поколения, основанного на применении высокотехнологичного оборудования (секвенаторов) и мощных вычислительных систем (биоинформатика), является широкий спектр одномоментно изучаемых генов и высокая точность в сочетании с умеренной стоимостью.
Какой лучше: достоинства и недостатки разных методов молекулярной диагностики
Среди современных видов молекулярной генетической диагностики в онкологии наибольшее применение имеют ПЦР (полимеразно-цепная реакция) и секвенирование нового поколения (NGS, next generation sequencing), которые практически вытеснили из клинической практики ранее имевшее широкое применение секвенирование по Сэнгеру.
Остальные методы либо уступают по информативности и точности получаемых данных, либо используются исключительно в научной деятельности из-за высокой стоимости тестирования.
Отдельно следует упомянуть цитогенетический метод FISH (флуоресцентная гибридизация in situ). Так называемый FISH-тест выполняется для подтверждения предположений клинического онколога о наличии специфических мутаций в определенных генах и служит для избрания оптимальной тактики лечения. Однако более корректно отнести FISH к разделу морфологических исследований, так как основой метода является микроскопическая визуализация процесса взаимодействия компонентов во время исследования. В таком случае любые заключения являются субъективными и зависят от квалификации специалистов, выполняющих диагностику. Кроме того, некорректно сравнивать FISH-тест с другими видами генетической диагностики - часто FISH имеет специфическое применение в качестве единственного возможного метода диагностики, например, при таких заболеваниях, как миелолейкоз, лейкоз, хронический лимфолейкоз и др.
NGS (секвенирование нового поколения)
Позволяет рассмотреть все мутации в заданном списке генов в рамках одного исследования (исследование панели генов), давая полную картину имеющихся мутаций, что позволяет избежать дополнительного тестирования. Важное значение данного метода генетической диагностики для медицины нашло отражение в самом его названии - “новое поколение” характеризует превосходство в объеме и точности предоставляемой информации.
Обработка огромного количества информации о ДНК конкретного человека, получаемого при NGS, позволяет:
- определить и описать (указать расположения в конкретном гене) отклонения от нормального для популяции строения ДНК;
- сравнить имеющиеся сочетания различных мутаций с базами данных для определения фактора онкогенности (способности вызывать онкологическое заболевание) выявленных “наборов” мутаций;
- если выполняется наследственный ДНК-онкотест на базе NGS - не только выявить мутации, ассоциированные с наследственными (семейными) раками, но и указать в заключении на необходимость дополнительной консультации с онкологом для принятия мер по предупреждению и раннему выявления начала заболевания.
Значительный объем данных, получаемых при выполнении секвенирования генома, обуславливает продолжительность выполнения NGS-секвенирования генома. Например, изучение панели наиболее распространенных генов, мутации в которых имеют клиническую значимость в онкологии (примерно 30 генов), методом NGS выполняется в срок 20-30 рабочих дней.
Технологические возможности секвенаторов, работающих в лаборатории МИБС, позволяют говорить о резерве снижения срока выполнения тестирования по мере роста спроса на профессиональную генетическую диагностику со стороны российских онкологов из других регионов. С конца 2021 года МИБС предлагает удобную схему логистики образцов тканей опухолей и образцов крови для выполнения NGS-исследований, что открывает доступ к высокотехнологичной диагностике онкологу из любого региона, тем самым повышая качество лечения онкологических заболеваний на уровне государства.
Для выбора наиболее оптимальной схемы лечения с включением в ее состав иммунотерапии либо таргетной терапии, клинические онкологи лечебных центров, входящих в структуру МИБС (Онкологическая клиника МИБС, Центр протонной терапии МИБС) используют данные NGS, полученные в собственной молекулярно-генетической лаборатории
ПЦР (полимеразная цепная реакция)
Полимеразная цепная реакция - это хорошо знакомый, точный и востребованный метод определения мутаций в указанных генах. Именно ПЦР, точнее, информация о мутациях в наиболее распространенных генах (чаще всего BRAF-мутации, а также BRCA1/BRCA2, EGFR, HRAS, KRAS, MET) стал основой развития технологий таргетной терапии и иммунотерапии.
С появлением секвенирования нового поколения метод ПЦР утрачивает клиническую важность при необходимости исследования широкой панели генов. В таком случае невысокая стоимость и небольшой срок выполнения исследования, являющиеся преимуществом ПЦР при решении точечных диагностических задач при необходимости всестороннего изучения генов у онкологических пациентов не перекрывают определенных ограничений, которые присущи ПЦР.
В первую очередь, это недостаточная информативность - один ПЦР-анализ позволяет проверить мутацию в одном конкретном гене, которую может предположить врач-онколог. В случае подозрения о наличии мутаций в различных генах необходимо многократное повторение ПЦР-тестирования на каждом из интересующих участков ДНК. Это резко повышает общую стоимость исследования и длительность самого процесса диагностики, требует проведения дополнительной биопсии для получения дополнительного объема опухолевых тканей, что также увеличивает общий срок и стоимость исследований.
Сравнение полноты исследования генетических мутаций между ПЦР и секвенированием нового поколения (NGS)
Рассмотрим «разрешающую способность» этих двух методов на примере тестирования образца опухоли у пациентки с необходимостью выявления возможных мутаций BRCA1/BRCA2. На двух иллюстрациях ниже розовым отмечены зоны генов, которые возможно исследовать этими двумя методами:
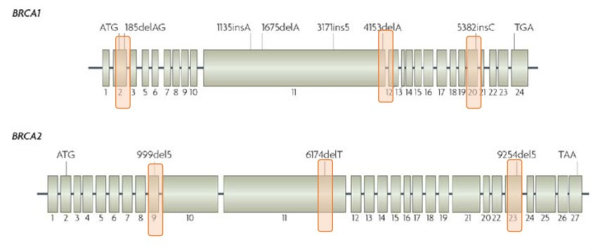
ПЦР исследование - позволяет диагностировать только 4-10 частых мутаций из более чем 3000 описанных патогенных в базах данных, рассматривается только 2 гена из более чем 100 генов (к.м.н. Гордиев М.Г., из личного архива)
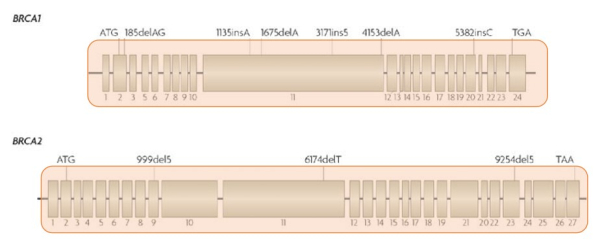
Cеквенирование нового поколения (NGS) - диагностируются все мутации в генах BRCA1/BRCA2, а также все мутации в других генах (к.м.н. Гордиев М.Г., из личного архива)
При этом даже многократное ПЦР-тестирование опухоли, в отличие от метода секвенирования нового поколения (NGS), не дает исчерпывающей информации о мутациях в генах, не вошедших в список для изучения. Это может приводить к ложно-отрицательным результатам в случае редких генетических мутаций, либо при недостаточно полной формулировке диагностической задачи со стороны направляющего врача-онколога.
Секвенирование по Сэнгеру
С развитием других методов генетической диагностики данный метод постепенно выходит из клинической практики. Основной недостаток метода Сэнгера - низкая чувствительность. Это означает, что для выявления генной мутации обязательным условием является наличие в предоставленных образцах опухолевых тканей не менее 15-20% клеток с мутациями. Из-за неравномерности распределения клеток в объеме солидных опухолей применение секвенирования по Сэнгеру приводит к значительному количеству ложно-отрицательных результатов (как следствие - пациенту проводится лечение, которое не будет эффективным).
Учитывая развитие и доступность в России (в том числе по ОМС в МИБС) более современных методов генетической диагностики можно сказать, что на начало 2022 года применение секвенирования по Сэнгеру обусловлено реактивностью мышления и недостаточной информированностью некоторых врачей, которые игнорируют более современные технологии.
При каких видах рака нужна молекулярно-генетическая диагностика?
Список основных видов рака, при лечении которых информация о генных мутациях имеет практическую клиническую ценность:
- немелкоклеточный рак легкого - гены EGFR, BRAF, KRAS, MET, NRAS, ERBB2, JAK2, JAK3
- рак толстой кишки (колорректальный рак) - гены KRAS, NRAS, BRAF
- меланома - гены BRAF, NRAS, KIT
- гастроинтестинальная стромальная опухоль - гены PDGFRA, KIT
- глиальные опухоли, острый миелоидный лейкоз - гены IDH1, IDH2
- рак молочной железы - гены PIK3CA, BRCA1, BRCA2
- рак яичников - гены BRCA1, BRCA2, TP53
Секвенирование нового поколения в МИБС: в чем преимущество?
Наша лаборатория использует NGS-секвенирование на оборудовании Illumina, являющееся на начало 2022 года “золотым стандартом” в отрасли секвенирования генома. Данное оборудование, точнее, технологический цикл секвенирования с использованием оборудования Illumina, обеспечивает высокую скорость расшифровки (секвенирования) ДНК и относительно низкую стоимость исследования, позволяющую использовать этот современный диагностический метод в широкой клинической практике. Интерпретация полученных данных проводится в соответствии с постоянно дополняемыми международными информационными базами мутаций.
В нашей лаборатории работают уникальные специалисты, имеющие профессиональную подготовку и богатый подтвержденный опыт как клинической, так и научной работы в направлении секвенирования генома. Вовлеченность в международное профессиональное сообщество и постоянное взаимодействие с клиническими онкологами и химиотерапевтами лечебных центров МИБС позволяет оперативно реагировать на потребности отрасли.
Именно поэтому услуги молекулярно-генетической лаборатории МИБС востребованы онкологами по всей РФ - с конца 2021 года образцы для выполнения исследования можно передать в любом из региональных центров МИБС либо отправить курьерской службой (для получения подробной информации о логистике образцов, обратитесь любым из доступных на сайте способов).
К тому же большинство исследований, связанных с определением эффективности лечения, могут быть выполнены в нашей лаборатории за счет ОМС, независимо от региона проживания гражданина РФ.
Чтобы заказать генетический анализ опухоли методом NGS в МИБС по ОМС, звоните +7 (812) 244-06-31, пишите ngs@ldc.ru или заполните форму обратной связи и наши специалисты свяжутся с Вами в кратчайший срок для уточнения информации
Комплексное геномное профилирование
С июля 2022 молекулярно-генетическая диагностика в МИБС вышла на новый уровень: внедрена услуга комплексного геномного профилирования (в партнерстве с Foundation Medicine, частью международной компании Roche).
Комплексное геномное профилирование (КГП) определяет уникальный молекулярный профиль опухоли, изучая список из 324 генов, значимых с точки зрения лечения онкологических заболеваний. Тест выполняется в рамках одного биоматериала (парафиновые блоки образцов опухоли либо образец крови, в зависимости от заболевания) во внешней лаборатории Foundation Medicine (Пензбург, Германия).
Результаты КГП позволяют оптимизировать проводимую противоопухолевую терапию у детей и взрослых, назначив персонализированное таргетное лечение при любых солидных опухолях, гемобластозах, саркомах.
По результатам проведения КГП также определяются клинические исследования, в которых могут принять участие пациенты, исходя из их геномного профиля.
Комплексное геномное профилирование (КГП) выполняется на коммерческой основе, однако стоимость данного исследования в МИБС - одна из самых низких в РФ. Наши пациенты имеют возможность передать образцы на тестирование, заключив договор на получение услуги в любом из 79 региональных диагностических центров МИБС в более чем 60 городах РФ.
Общее время ожидания результатов КГП, включая транспортировку, составит 5-6 недель. Отчет, полученный из Германии, будет содержать информацию о выявленных генетических изменениях, клинически эффективных видах терапии и ведущихся клинических исследованиях, участие в которых рекомендовано пациенту, исходя из его геномного профиля.
ДНК-тест рисков наследственного рака (на основе NGS)
С появлением метода секвенирования генома нового поколения, позволяющего одномоментно проанализировать широкую панель генов и сравнить с имеющейся всемирной базой выявленные мутации, на новый виток развития выходят программы предупреждения и ранней диагностики широкого ряда онкологических заболеваний - программы скрининга, которые включают исследование наследственных рисков развития онкозаболеваний.
На сегодня научно доказано, что на долю наследственного фактора приходится до 20% всех случаев некоторых видов онкологических заболеваний (например, наследственный рак молочной железы или рак яичников). У пациентов, несущих гены семейных раков, вероятность развития онкологического заболевания составляет до 90% вместо среднего для популяции значения в 10%. В целом 1,5-2% всех людей в популяции имеют генные мутации, которые говорят о повышенном риске рака.
Наиболее частые наследственные (семейные) раки:
- рак молочной железы (как у женщин, так и у мужчин);
- рак яичников;
- рак предстательной железы;
- колоректальный рак;
- рак поджелудочной железы;
- рак желудка;
- меланома.
Наиболее оптимальным вариантом является ДНК тест наследственного рака у тех, кто входит в группу риска - семейная история одного вида рака в нескольких поколениях, наличие особенностей течения заболевания (например, двусторонний рак молочной железы, рак груди у мужчин, рак яичников или молочной железы в возрасте до 50 лет и др.). В такой группе вероятность развития опухолей значительно выше, чем у просто носителей мутаций.
Чтобы заказать ДНК-тест рисков наследственного рака в МИБС, звоните +7 (812) 244-06-31, пишите ngs@ldc.ru или заполните форму обратной связи и наши специалисты свяжутся с Вами в кратчайший срок для уточнения информации
Фактически, предоставив в лабораторию МИБС образец крови, можно предсказать рак. И, если ДНК-тестирование покажет наличие определенного набора генных мутаций, у пациента в сотрудничестве с врачом-генетиком и врачом-онкологом появляется шанс предпринять необходимые радикальные либо терапевтические действия, чтобы снизить или полностью исключить риск развития данного вида рака.
Самым известным примером такого подхода является актриса Анджелина Джоли, в семейной истории которой было несколько случаев рака молочной железы. Этот фактор в сочетании с выявленными мутациями в генах BRCA1 и BRCA2 показал максимальную вероятность раннего развития рака. Поэтому актриса выбрала наиболее радикальный путь (двухсторонняя мастэктомия и тотальная овариэктомия). В других случаях возможны и более мягкие решения в пределах персонализированного скрининга: более пристального наблюдения с более частой диспансеризацией, расширение состава скрининга (например, регулярная дерматоскопия у пациентов с семейной меланомой, МРТ молочных желез для молодых пациенток с семейным раком груди, контроль динамики уровня ПСА у пациентов с наследственным раком простаты).



