Лучевая терапия опухолей - один из наиболее известных терминов онкологии, подразумевающий использование ионизирующего излучения для разрушения опухолевых клеток.
Изначально лучевое лечение использовало принцип большей устойчивости здоровых клеток к воздействию радиации, в сравнении со злокачественными. При этом в зону расположения опухоли подавали высокую дозу излучения (за 20-30 сеансов), что приводило к разрушению ДНК клеток опухоли.
Развитие способов воздействия ионизирующего излучения на опухоль привело к изобретению новых направлений в радиационной онкологии. Например, радиохирургии (Гамма-нож, Кибер-нож), при которой высокая доза радиации однократно (либо за несколько сеансов) подается точно в границы новообразования и приводит к биологическому разрушению его клеток.
Эволюция медицинской науки и технологий лечения рака привела к тому, что классификация видов лучевого лечения (радиотерапии) довольно сложна. И пациенту, столкнувшемуся с лечением онкозаболевания, сложно самостоятельно определить, насколько подходит в его случае тип лучевого лечения опухолей, предложенный в конкретном онкоцентре России и зарубежья.
Данный материал призван дать ответы на наиболее частые вопросы пациентов и их близких о лучевой терапии. Тем самым повысить шансы каждого на получение того лечения, которое будет эффективным, а не того, которое ограничено парком медицинской техники конкретного лечебного учреждения в России или другой стране.
ВИДЫ ЛУЧЕВОЙ ТЕРАПИИ
Традиционно в радиотерапии выделяют три способа воздействия ионизирующего излучения на опухоль:
Наивысшего технического уровня достигло лучевое лечение, при котором доза излучения доставляется бесконтактно, с небольшого расстояния. Дистанционная лучевая терапия проводится как с использованием ионизирующего излучения радиоактивных радиоизотопов (современная медицина использует дистанционное излучение изотопов только при радиохирургии на Гамма-ноже, хотя в некоторых онкоцентрах России все еще можно встретить старые аппараты для радиотерапии работающие на изотопе кобальта), так и с применением более точных и безопасных ускорителей элементарных частиц (линейный ускоритель или синхроциклотрон при протонной терапии).
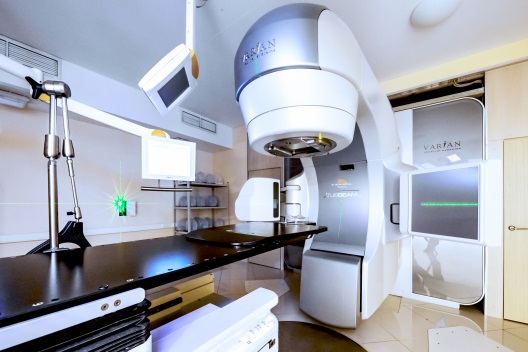
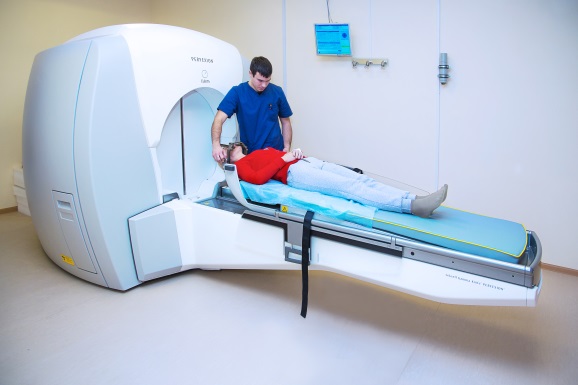
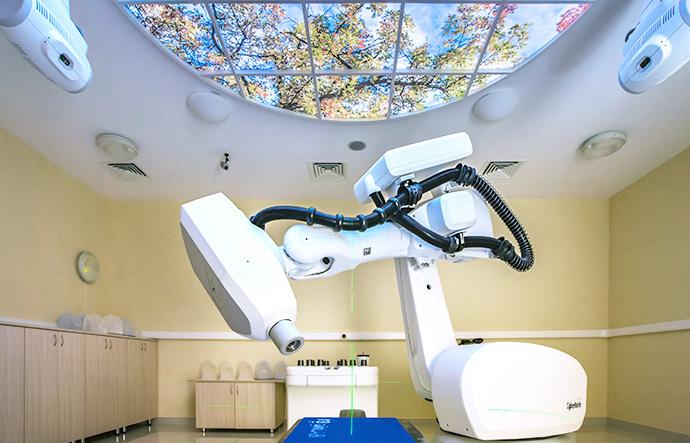
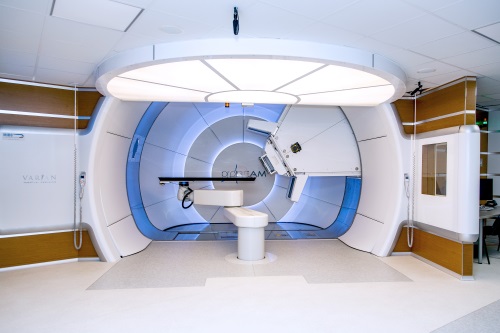
Так выглядят современные аппараты для дистанционного лучевого лечения опухолей (слева направо, сверху вниз): Линейный ускоритель, Гамма-нож, Кибер-нож, Протонная терапия
Брахитерапия - воздействие источников ионизирующего излучения (изотопов радия, йода, цезия, кобальта и др.) на поверхность опухоли, либо их вживление в объем новообразования.

Одно из “зерен” с радиоактивным материалом, вживляемых в опухоль при брахитерапии
Наиболее популярно применение брахитерапии для лечения опухолей, к которым имеется относительно простой доступ: рак шейки и тела матки, рак языка, рак пищевода и т.д.
Радионуклидная лучевая терапия подразумевает собой введение микрочастиц радиоактивного вещества, накапливаемых тем или иным органом. Наибольшее развитие получила радиойодтерапия при которой вводимый радиоактивный йод накапливается в тканях щитовидной железы, разрушая опухоль и ее метастазы высокой (абляционной) дозой.
Некоторые из выделяемых в отдельные группы видов лучевого лечения, как правило, имеют в своей основе один из трех указанных выше способов. Например, интраоперационная лучевая терапия (ИОЛТ), проводимая на ложе удаленной опухоли во время хирургического вмешательства - это обычная лучевая терапия на линейном ускорителе меньшей мощности.
Виды дистанционной лучевой терапии
Эффективность радионуклидной лучевой терапии и брахитерапии зависит от точности расчета дозы и соблюдения технологического процесса, а приемы реализации этих методов не демонстрируют большого разнообразия. Но дистанционная лучевая терапия имеет массу подвидов, каждый из которых характеризуется своими особенностями проведения и показаниями для применения.
Высокая доза подводится единоразово, либо короткой серией фракций. Может проводиться на Гамма-ноже или Кибер-ноже, а также на некоторых линейных ускорителях.
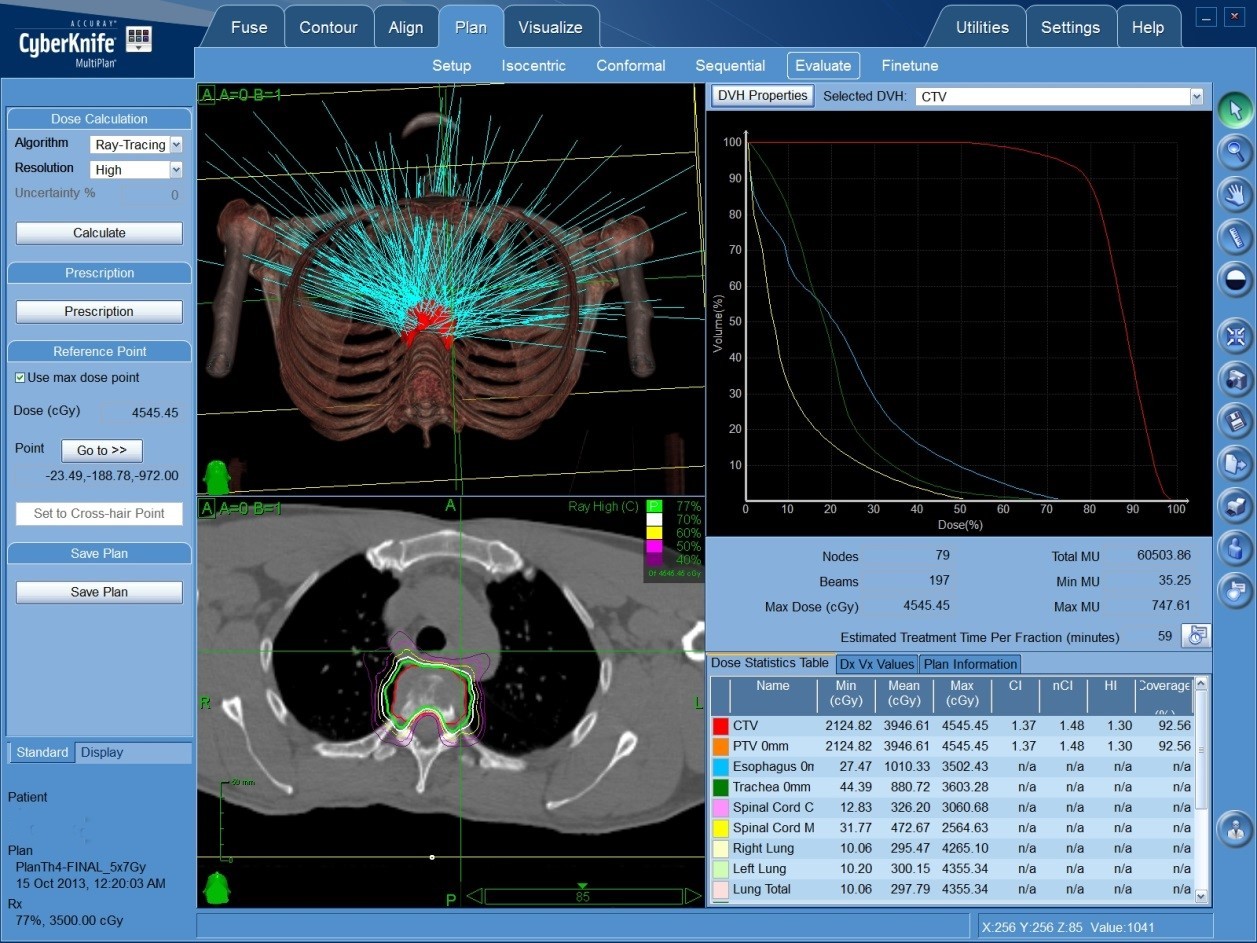
Один из примеров плана радиохирургии на Кибер-ноже. Множество тонких пучков (бирюзовые лучи в левой верхней части), пересекаясь в области расположения опухоли позвоночника, формируют зону высокой дозы ионизирующего излучения (зона внутри красного контура), которая складывается из дозы каждого отдельного луча.
Наибольшее распространение радиохирургия получила в лечении опухолей головного мозга и позвоночника (в том числе доброкачественных), являясь бескровной альтернативой традиционному хирургическому лечению на ранних стадиях. Успешно применяется и для лечения четко локализованных опухолей (рак почки, рак печени, рак легкого, увеальная меланома) и ряда неонкологических заболеваний, таких как сосудистые патологии (АВМ, каверномы), невралгии тройничного нерва, эпилепсии, болезни Паркинсона и др.).
- лучевая терапия на линейном ускорителе
Обычно, 23-30 сеансов лечения фотонами для опухолей внутри тела, либо электронами для поверхностных опухолей (например, базалиома).
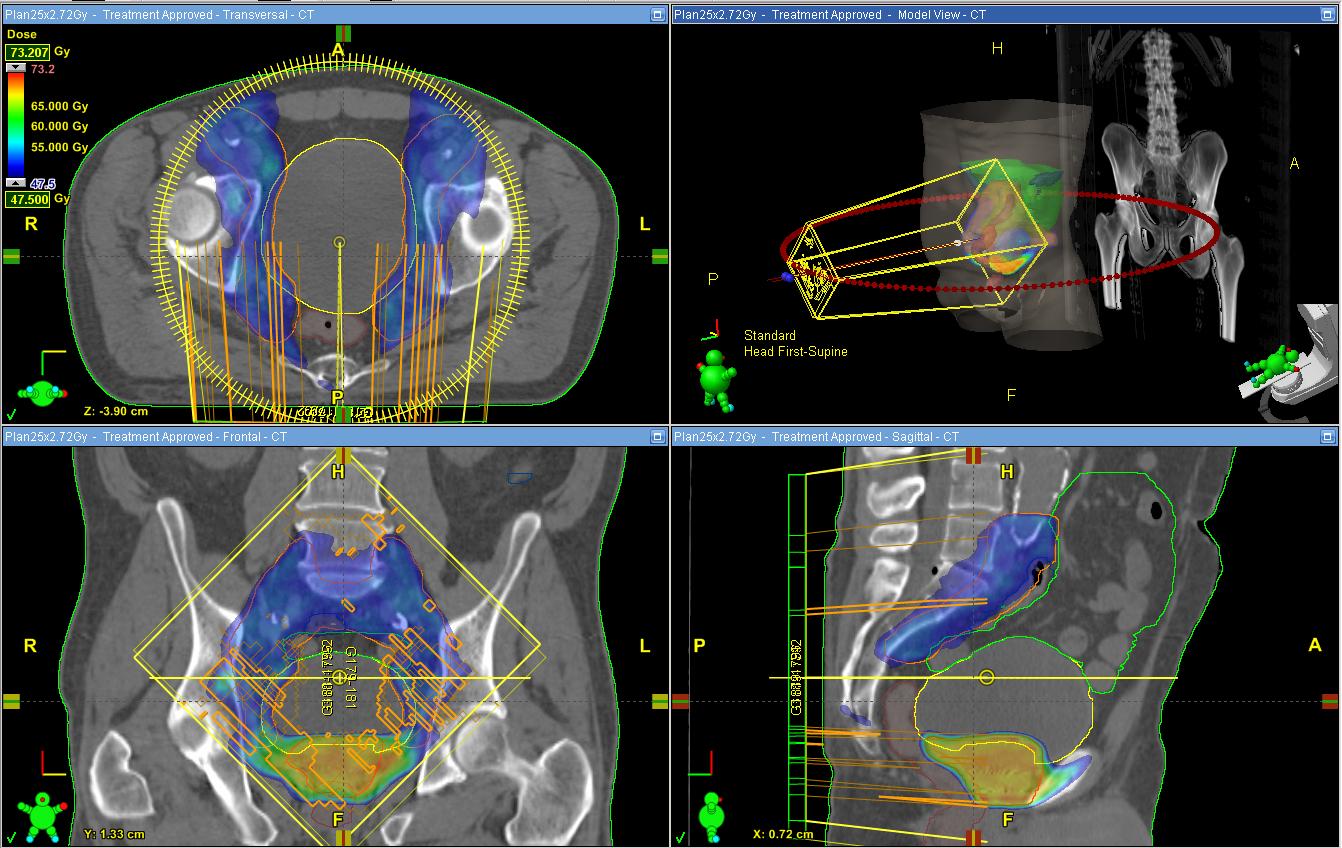
Пример плана лучевой терапии при лечении рака простаты на современном линейном ускорителе (используется метод VMAT: RapidArc®). Высокая доза излучения, губительная для опухолевых клеток (зона, окрашенная в красные и желтые оттенки) складывается в зоне пересечения полей различной формы, поданных из различных положений. При этом здоровые ткани, которые окружают опухоль либо через которые проходит каждое из полей, получают толерантную дозу, не вызывающую необратимых биологических изменений.
Линейный ускоритель - важный компонент в составе сочетанного лечения опухолей любой стадии и любой локализации. Современные линейные ускорители, помимо возможностей модификации формы каждого из полей излучения для максимальной защиты здоровых тканей от радиации, могут агрегироваться с томографами для еще большей точности и скорости лечения.
- лучевая терапия на радиоизотопных аппаратах
Ввиду низкой точности эта разновидность лечения, практически не применяется в мире, а рассматривается по причине того, что значительная часть лучевой терапии в государственной онкологии России все еще проводится на таком оборудовании. Единственный из методов, не предлагаемый в МИБС.
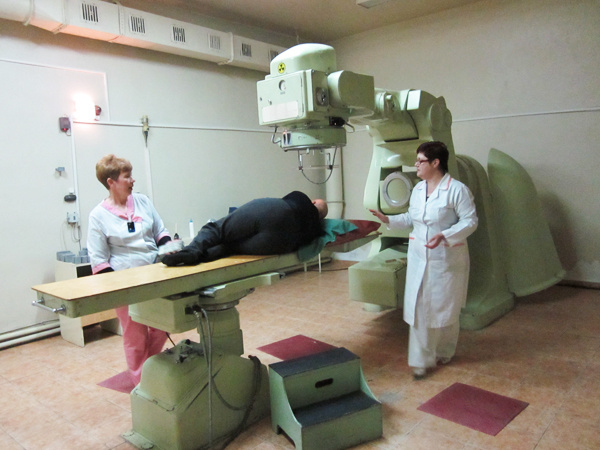
Привет из 70-х - гамма-терапевтический аппарат “Рокус”. Это - не музейный экспонат, а оборудование, на котором проходят лечение пациенты одного из государственных онкоцентров
Наиболее эффективный, точный и безопасный вид воздействия на опухоль элементарными частицами протонами. Особенность протонов - высвобождение максимальной энергии на конкретном контролируемом участке траектории полета, что в разы снижает лучевую нагрузку на организм, даже в сравнении с современными линейными ускорителями.
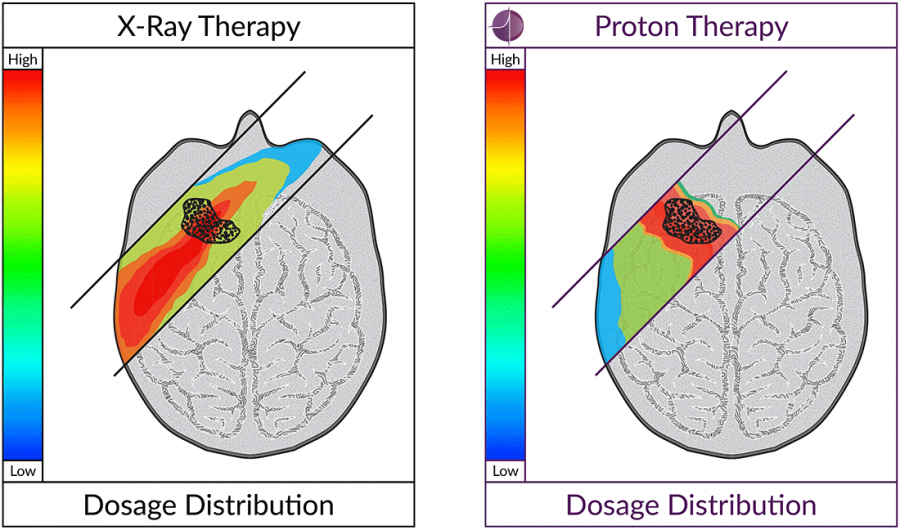
Слева - прохождение поля фотонов при лечении на линейном ускорителе, справа - прохождение протонного пучка при протонной терапии.
Красная зона - зона максимальной дозы излучения, синяя и зеленые - зоны умеренного облучения.
Уникальность свойств протонной терапии делает этот метод лечения одним из наиболее эффективных в лечении опухолей у детей.
НАСКОЛЬКО БЕЗОПАСНА ЛУЧЕВАЯ ТЕРАПИЯ СЕГОДНЯ?
С момента изобретения радиотерапии основным аргументом противников этого метода лечения опухолей было воздействие радиации не только на объем опухолевого поражения, но и на здоровые ткани организма, которые окружают зону облучения или находятся на пути его прохождения при дистанционном лучевом лечении опухолей.
Но даже несмотря на ряд ограничений, которые существовали при применении первых установок для лучевого лечения опухолей, радиотерапия в онкологии с первых дней изобретения прочно занимает основное место в лечении различных типов и видов злокачественных новообразований.
Точное дозирование
Эволюция безопасности лучевой терапии начиналась с точного определения толерантных (не вызывающих необратимых биологических изменений) доз ионизирующего излучения для различных типов здоровых тканей организма. Одновременно с тем, как ученые научились контролировать (и дозировать) количество излучения, начались работы по управлению формой поля облучения.
Современные аппараты для лучевой терапии позволяют создавать зону высокой дозы излучения, отвечающую форме опухоли, из нескольких полей в зоне их пересечения. При этом форма каждого поля моделируется управляемыми многолепестковыми коллиматорами (специальное электромеханическое устройство, “трафарет”, принимающий заданные формы и пропускающий поле требуемой конфигурации). Поля подаются из различных позиций, что распределяет общую дозу радиации между различными здоровыми частями организма.
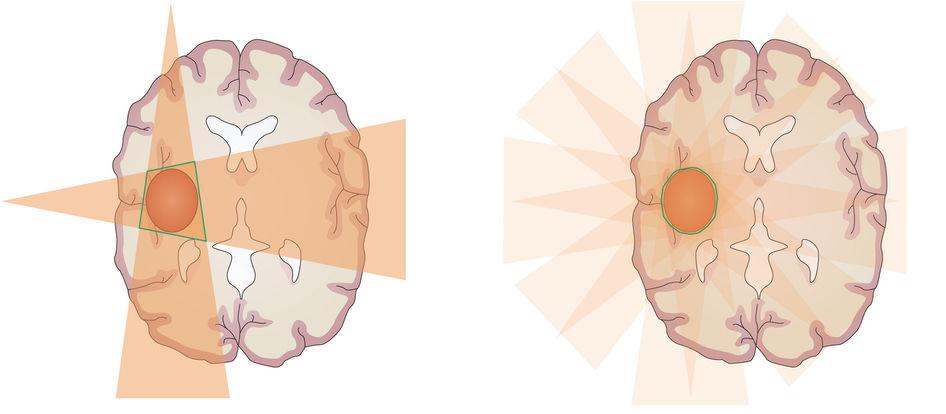
Слева - конвенциональная лучевая терапия (3D-CRT) - зона высокой дозы излучения (зеленый контур) сформирована на пересечении двух полей, она превышает объем расположения опухоли, что ведет к повреждению здоровых тканей, как в зоне пересечения, так и в зоне прохождения двух полей высокой дозы.
Справа - модулируемая по интенсивности лучевая терапия (IMRT) - зона высокой дозы, сформированная пересечением четырех полей. Ее контур максимально приближен к контуру новообразования, здоровые ткани на пути прохождения полей получают, как минимум, вдвое меньшую дозу. В настоящее время при IMRT не редкость применение десяти и более полей, что значительно снижает общую лучевую нагрузку.
Точное наведение
Ключевым в поиске решений, которые дали бы возможность нивелировать воздействие радиации на здоровые ткани организма, особенно при лечении опухолей сложной формы, стали разработки в направлении виртуальной симуляции лучевой терапии. Высокая точность компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ) позволяют не только четко определить наличие и контуры опухоли на каждом из множества снимков, но и воссоздать на специализированном программном обеспечении трехмерную цифровую модель взаимного расположения опухоли сложной формы и окружающих ее здоровых тканей. Этим достигается, в первую очередь, защита критически важных для работы организма структур (ствол головного мозга, пищевод, зрительный нерв и т.д.), даже минимальное облучение которых чревато серьезными побочными эффектами.
Контроль положения
Ввиду того, что курс лучевой терапии предусматривает несколько десятков сеансов, важной составляющей точности и безопасности такого лечения является отслеживание смещения пациента во время каждого сеанса лечения (фракции). Для этого применяют фиксацию пациента специальными устройствами, эластичными масками, индивидуальными матрасами, а также инструментальный контроль за положением тела пациента относительно плана лечения и смещением “контрольных точек”: рентгенографический, КТ- и МРТ-контроль.
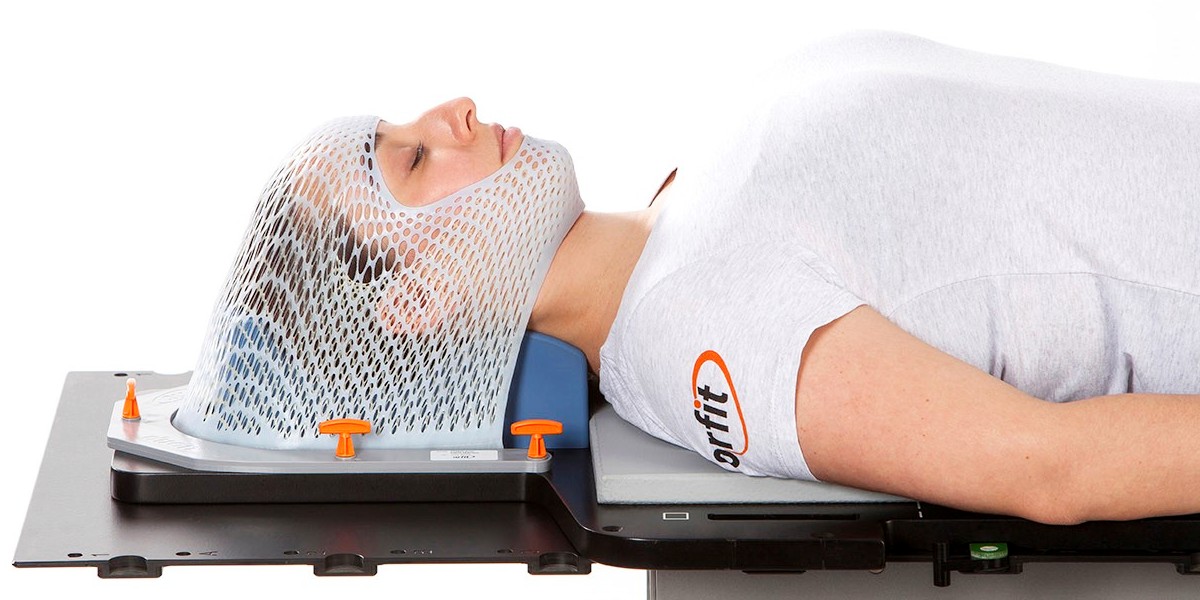
Фиксация положения пациента при лучевой терапии и радиохирургии эластичной маской, изготовленной индивидуально. Наркоз не требуется!
Точный выбор метода лучевого лечения
Отдельно следует рассмотреть такое направление повышения безопасности лучевой терапии, как использование индивидуальных свойств различных элементарных частиц.
Так, современные линейные ускорители кроме лучевого лечения фотонами, позволяют проводить электронотерапию (лучевую терапию электронами), при которой подавляющая часть энергии элементарных частиц, электронов, высвобождается в верхних слоях биологических тканей, не вызывая облучения более глубоких структур, находящихся под опухолью.
Аналогично, протонная терапия позволяет доставлять в опухоль элементарные частицы протоны, энергия которых максимальна лишь на коротком отрезке дистанции “полета”, соответствующем расположению опухоли в глубине организме.
Подобрать метод лечения, которое будет наиболее эффективным в каждом конкретном случае, может только врач, владеющий каждым из методов лучевой терапии.
ЛУЧЕВАЯ ТЕРАПИЯ - ВАЖНАЯ ЧАСТЬ СОЧЕТАННОГО ЛЕЧЕНИЯ ОПУХОЛЕЙ
Несмотря на успехи лучевой терапии в борьбе с локализованными опухолями, она - лишь один из инструментов современной онкологической помощи.
Наибольшую эффективность доказал комплексный подход к лечению рака, при котором лучевое лечение применяется в таких видах:
- предоперационный курс для уменьшения активности и объема опухоли (неоадъювантная лучевая терапия);
- послеоперационный курс для облучения зон, в которых невозможно достичь полного удаления опухоли, а также путей вероятного метастазирования, чаще всего, лимфатических узлов (адъювантная лучевая терапия);
- лучевая терапия при объемных метастатических поражениях, например, полное облучение головного мозга (WBRT) самостоятельно, либо в комбинации со стереотаксической радиохирургией (SRS) на Гамма-ноже или Кибер-ноже;
- паллиативное лечение для облегчения болей и общего состояния организма на терминальной стадии заболевания и т.д.
СКОЛЬКО СТОИТ ЛУЧЕВАЯ ТЕРАПИЯ?
Стоимость лучевого лечения зависит от индивидуальных особенностей клинического случая, вида радиотерапии, сложности формы опухоли, длительности и объема курса лучевой терапии, показанного пациенту.
На стоимость лучевой терапии (для сравнимых методик) влияют технические особенности процесса лечения, точнее, себестоимость подготовки и проведения лечения.
К примеру, курс лучевого лечения в региональном онкоцентре, включающий облучение двумя встречными квадратными полями после простого определения контуров опухоли на МРТ и нанесении маркером на кожу меток для примерной настройки положения поля, будет недорогим. Но прогноз и уровень побочных эффектов, присущие такому лечению - малоутешительны.
Поэтому стоимость лучевого лечения на современном линейном ускорителе, требующего затрат на приобретение и обслуживание высокотехнологичного оборудования, а также связанного с большим объемом работы квалифицированных специалистов (лучевых терапевтов, медицинских физиков), - оправданно выше. Но такое лечение эффективнее и безопаснее.
В МИБС мы достигаем высоких показателей эффективности лечения за счет обеспечения качества процесса на каждом из этапов: подготовки виртуальной трехмерной модели опухоли с дальнейшим определением контуров объемов максимальных и нулевых доз, расчетом и коррекцией плана лечения. Только после этого может быть начат курс лучевой терапии, во время каждой фракции которого применяется множество полей различных форм, “огибающих” здоровые ткани организма, и проводится многоступенчатая верификация положения пациента и самой опухоли.
ЛУЧЕВАЯ ТЕРАПИЯ В РОССИИ
Уровень отечественных онкологов, медицинских физиков, лучевых терапевтов, при условии постоянного повышения их квалификации (что является обязательным для специалистов МИБС), не уступает, а, зачастую, превосходит уровень ведущих мировых специалистов. Широкая клиническая практика позволяет быстро получать значительный опыт даже молодым специалистам, парк оборудования регулярно пополняется новейшими аппаратами для лучевого лечения от лидеров отрасли (даже в таких затратных сферах, как протонная терапия и радиохирургия).
Поэтому все чаще иностранные граждане, даже из тех стран, которые считаются традиционным “пунктом назначения” для выездного медицинского туризма из России, вдохновленные успехами российской медицины, выбирают лечение рака в частных онкоцентрах Российской федерации, в том числе, и в МИБС. Ведь стоимость лечения рака за границей (при сравнимом уровне качества) выше не из-за качества медицины, а из-за уровня заработных плат иностранных специалистов и накладных расходов, связанных с перелетом, проживанием пациента и его сопровождающих, услугами переводчиков и т.д.
При этом доступность качественной лучевой терапии для граждан России, в рамках гарантированного государством объема медицинской помощи, оставляет желать лучшего. Государственная онкология все еще недостаточно оснащена современной техникой для диагностики и лечения, бюджеты государственных онкоцентров не позволяют на должном уровне обучать специалистов, высокая загруженность сказывается на качестве подготовки и планирования лечения.
С другой стороны, схема работы страховой медицины в России формирует спрос на наиболее дешевые методы, обеспечивающие лишь базовый уровень качества лечения рака, не создавая спроса на высокотехнологичные методы лечения, к которым относятся радиотерапия, радиохирургия, протонная терапия. Это отражается в низком уровне квот на лечение в рамках программы медицинского страхования.
Исправить положение призваны эффективно управляемые частные онкологические центры, предлагающие пациентам ту тактику лечения, которая будет оптимальной как с точки зрения эффективности, так и с точки зрения стоимости.

Так выглядит Центр протонной терапии Медицинского института Березина Сергея (МИБС)
Если Вы стоите перед непростым выбором, где начать лечение рака, обратитесь в Онкологическую клинику МИБС. Наши специалисты предоставят квалифицированную консультацию относительно выбора подходящего метода лучевой терапии и другого лечения (в соответствии с лучшими стандартами мировой онкологии), прогноза и стоимости такого лечения.
В случае, если требуется необходимость проверить адекватность рекомендуемых в другом онкоцентре методов и плана лечения потребностям Вашего клинического случая, в любом из Центров МИБС (как в России, так и за ее пределами) Вам будет предложено “второе мнение” относительно установленного диагноза, рекомендованного состава и объема лечения.
Запишитесь сейчас!
Иванов Павел Игоревич
заведующий отделением нейрорадиотерапии
нейрохирург высшей категории, радиотерапевт, кандидат медицинских наук.
Доцент кафедры онкологии, детской онкологии и лучевой терапии с курсом патоморфологии и молекулярной генетики ЧОУ МИБС
Заслуженный врач Российской Федерации
Действительный член Всемирного Общества пользователей Гамма-Ножа (LGKS).
Действительный член Европейского Общества функциональной и стереотаксической нейрохирургии (ESSFN).
Действительный член Международного Общества Стереотаксической Радиохирургии (ISRS)
https://orcid.org/0000-0003-3747-4181













